Carlos Portocarrero Sánchez
David Barreira Gomes Sobrinho
Bruno Ramalho de Carvalho
(1) Introdução
A síndrome dos ovários policísticos (SOP), anovulação crônica hiperandrogênica ou policistose ovariana, é um distúrbio endócrino heterogêneo e complexo, caracterizado por disfunção ovulatória, hiperandrogenismo e ovários morfologicamente policísticos1; embora tenha sido descrita em meados do século XIX por Chereau e Rokitansky, os conhecimentos acerca da síndrome foram aprofundados a partir dos estudos de Irving Stein e Michael Leventhal, cerca de 90 anos depois.
Identificar a síndrome na adolescência tem sido um desafio, atualmente utilizando os critérios de Rotterdam, são necessários a presença dos três critérios e a persistência da irregularidade menstrual após dois anos da menarca. (*1 )
(2) Epidemiologia
A SOP está presente em 5% a 12% das mulheres em idade reprodutiva, a depender dos critérios diagnósticos utilizados1, e representa a principal causa de hiperandrogenismo e anovulação nesse grupo de pacientes. Comumente associada a obesidade (50%) e resistência insulínica (RI) (50% a 90%), a SOP aumenta significativamente os riscos de diabetes melito (DM), hipertensão arterial sistêmica (HAS), síndrome metabólica e dislipidemia3,4,5,6. Dessa forma, essa condição não pode ser avaliada apenas como distúrbio ginecológico, mas merece abordagem minuciosa e sistemática para uma doença sistêmica, principalmente em mulheres obesas6.
(3) Etiopatogenia
A etiopatogenia da SOP é pouco conhecida, mas a base fisiopatológica está no hiperandrogenismo, de origem ovariana, adrenal ou periférica7 e a interação entre fatores genéticos e ambientais parece exercer papel fundamental para o surgimento da síndrome8. Entre as teorias etiopatogênicas mais difundidas, associa-se a SOP ao aumento da freqüência e amplitude dos pulsos de LH9, a distúrbios da resposta das células tecais ao LH10, à resistência à insulina e aos fatores de crescimento similares à insulina11. Recentemente, aventou-se a possibilidade da hipersensibilidade das células tecais à ação da insulina na ausência de resistência insulínica, por defeito intrínseco e não decorrente do estímulo crônico pelo LH12.
São múltiplos os mecanismos de interferência dos androgênios circulantes em excesso sobre a dinâmica ovulatória (Figura 1). Há influência negativa sobre o funcionamento do eixo hipotálamo-hipófise-ovários-adrenais partir do aumento da produção periférica de estrona, que leva à inibição da ação hipotalâmica da dopamina e, assim, aumenta os pulsos do hormônio liberador de gonadotrofinas (GnRH) e a secreção do hormônio luteinizante (LH), culminando com a hiperestimulação das células tecais ovarianas e a produção de mais androgênios. A redução da dopamina hipotalâmica pode levar, ainda, a aumento na secreção de prolactina, com estímulo à produção de androgênios pelas glândulas adrenais. Também ocorrem alterações do microambiente ovariano, com interferência negativa dos androgênios em excesso sobre o desenvolvimento folicular, o que acarreta o acúmulo de folículos atrésicos (microcistos) que, produtores de inibina, aumentam o retrocontrole negativo sobre a secreção hipofisária do hormônio folículo-estimulante (FSH), levando ao aumento na relação LH/FSH, comum entre as portadoras da SOP7.
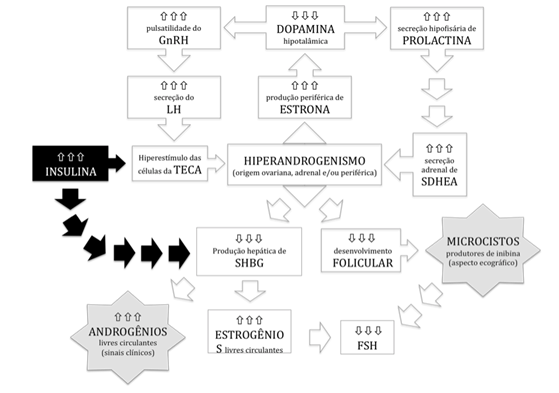
Figura 1. Mecanismos etiopatogênicos sugeridos para a Síndrome dos Ovários Policísticos
(4) Diagnóstico
Os achados e manifestações clínicas são variados, destacando-se hirsutismo, distúrbios menstruais, acne, obesidade, alopecia androgenética, infertilidade e acantose nigricans13,14.
Os primeiros critérios diagnósticos da SOP baseavam-se na presença do hiperandrogenismo clínico e/ou bioquímico e da anovulação crônica, após exclusão de doenças que pudessem levar a quadros semelhantes, como alterações da tireóide, hiperprolactinemia, síndrome de Cushing, hiperplasia congênita de supra-renal de início tardio e tumores produtores de androgênios de origem ovariana ou supra-renal13. A inclusão da morfologia ovariana à ultrassonografia como um dos critérios diagnósticos ocorreu apenas após o consenso de Rotterdam, realizado pela European Society for Human Reproduction and Embriology (ESHRE) e a American Society for Reproductive Medicine (ASRM)14. Ficou estabelecido que, para realizar o diagnóstico de SOP, são necessários dois dos três critérios a seguir: história de anovulação crônica (amenorréia e/ou oligomenorréia), hiperandrogenismo clínico (hirsutismo, acne, alopecia temporal, clitoromegalia, oleosidade da pele e do couro cabeludo) e/ou laboratorial (aumento dos níveis sanguíneos de testosterona livre ou total, ou sulfato de dehidroepiandrosterona) e ovários policísticos (OP) à ultrassonografia (US)15 com exclusão de outras condições clínicas que cursam com anovulação crônica e/ou hiperandrogenismo14.
Embora o consenso de Rotterdam seja o documento mais amplamente seguido e seus critérios adotados em todo o mundo para diagnóstico de SOP, fenótipos controversos (SOP na ausência de hiperandrogenismo) produziram questionamentos ainda pouco resolvidos. Considerando a definição de Rotterdam prematura e assumindo intuito de reverter controvérsias diagnósticas, a Androgen Excess Society (AES) emitiu documento de consenso em que considera a SOP como uma síndrome essencialmente hiperandrogênica16,17; assim, julgaram fundamentais para o diagnóstico o hiperandrogenismo clínico e/ou bioquímico, e a disfunção ovariana caracterizadas por oligo/anovulação e/ou ovários policísticos à ultrassonografia, desde que excluídas outras possíveis causas de excesso de androgênios (Quadro 1).

Oligo/Amenorréia
Avaliação de história menstrual, buscando sinais de irregularidade menstrual do tipo oligomenorréia (intervalo entre as menstruações maior que 36 e inferior a 90 dias) e amenorréia (intervalo entre as menstruações superior a 90 dias)14,18.
Hiperandrogenismo clínico
O hiperandrogenismo clínico é considerado na presença de acne de qualquer grau, alopecia e/ou hirsutismo14. Para avaliação clínica de hirsutismo, recomendamos o índice de Ferriman-Gallwey (Figura 2), que avalia a presença de pêlos terminais em nove áreas do corpo, com variação de 0 (ausência de pêlos terminais a 4 (grande número), em que paciente é considerada hirsuta quando o somatório das áreas for maior ou igual a 819.
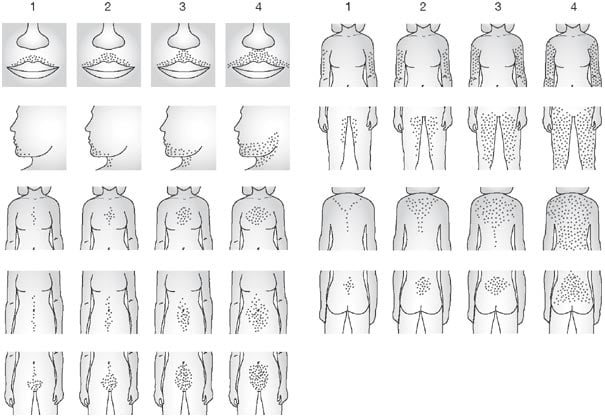
Figura 2. Escore semiquatitativo de Ferriman-Gallwey modificado (Reproduzido de: Yildiz BO. Assessment, diagnosis and treatment of a patient with hirsutism. Nat Clin Pract Endocrinol Metab. 2008;4(5):294-300).
Hiperandrogenismo Laboratorial
Dosar os androgênios para avaliar a possibilidade de hiperandrogenismo laboratorial14,20:
- Testosterona Total (VR = 15-80ng/dL em mulheres) tem baixa sensibilidade, mas é o androgênio para investigação de hiperandrogenismo de primeira linha20;
- Proteína carreadora dos esteróides sexuais (SHBG), cujo é VR = 18-114 nmol/L, para cálculo do Índice de Testosterona Livre14:
100 x Testosterona Total (ng/dL) x 3,47 ≤ 3,9 (VR)
SHBG (nmol/L)
- Testosterona livre e androstenediona não devem ser dosadas em ensaios habituais, em razão da baixa acurácia diagnóstica (a androstenediona deve estar mais associada a quadros de hiperandrogenismo de origem adrenal que aos de origem ovariana)14,20.
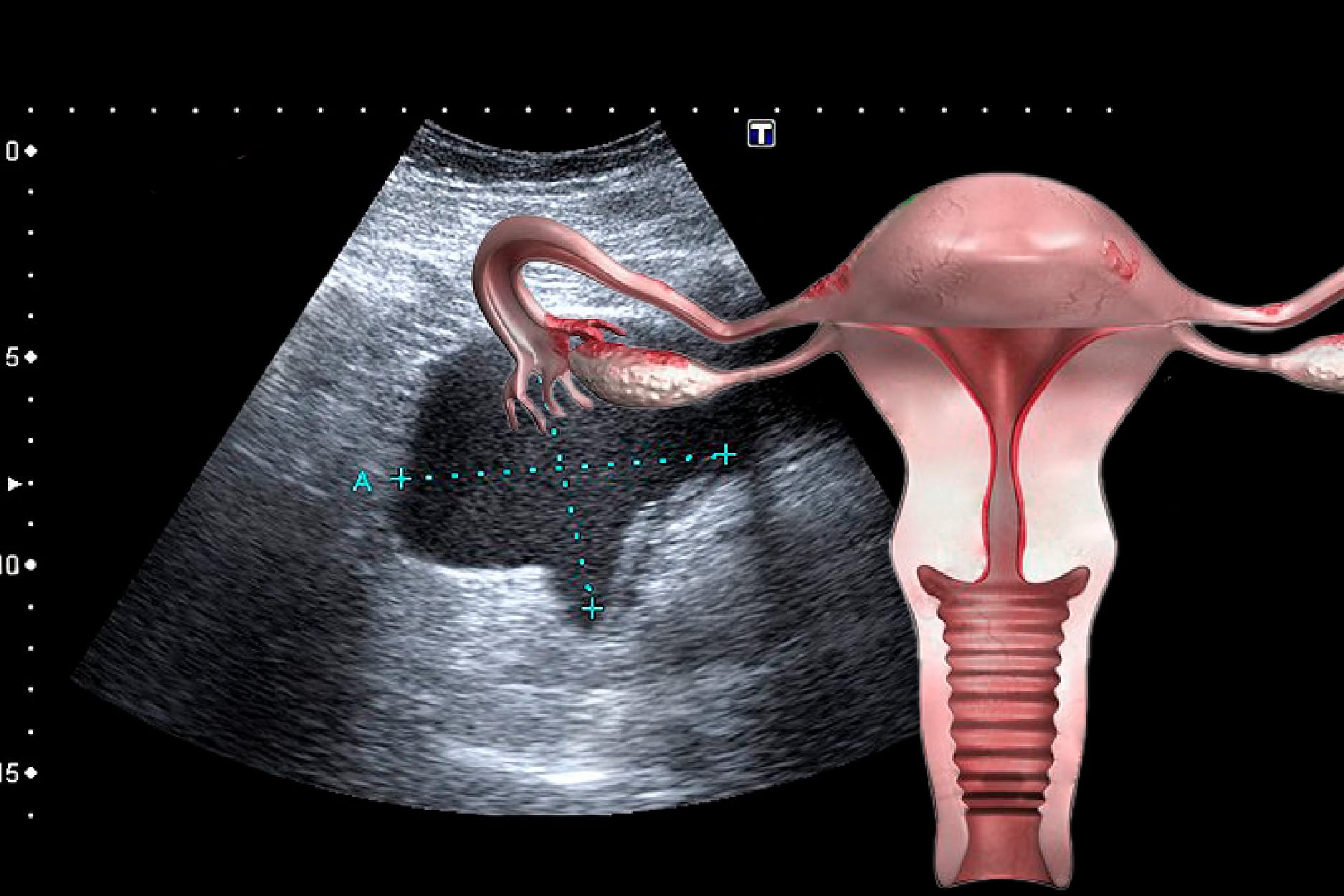
Avaliação Ultrassonográfica
Para que ultrassonografia seja compatível com ovários policísticos (OP) é necessário ter pelo menos um dos seguintes itens em pelo menos um dos ovários15:
- Presença de 12 ou mais folículos em cada ovário com medida entre 2-9 mm de diâmetro; OU
- Aumento de volume ovariano (> 10cm³).
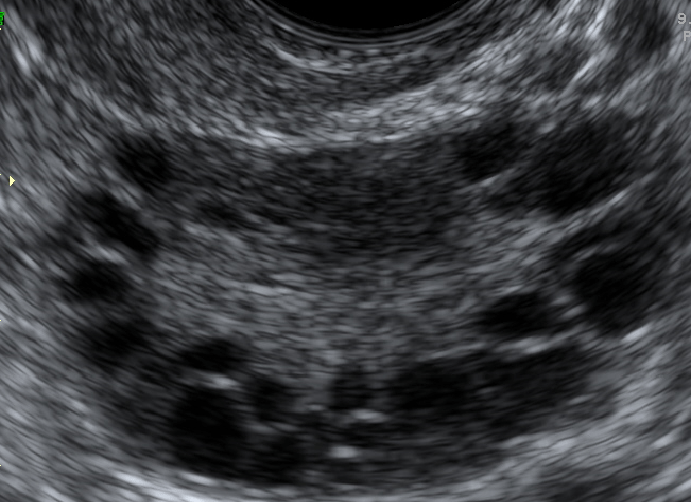
Figura 3. Aspecto ultrassonográfico dos ovários policísticos, identificando 12 ou mais folículos de 2-9 mm de diâmetro.
Quando há evidência de dominância folicular (folículo com diâmetro médio maior que 10 mm) ou de ovulação recente (corpo lúteo), a ultrassonografia deverá ser repetida no próximo ciclo e a conclusão diagnóstica, postergada. É importante salientar que a distribuição periférica e o aumento da ecogenicidade ovariana podem ser omitidos, já que, sem as características citadas anteriormente, não servem para o diagnóstico de OP15.
Além disso, essa definição não se aplica em mulheres em uso de anticoncepcionais orais. Mulheres que estejam menstruando regularmente deverão ser submetidas à avaliação US na fase folicular precoce (3-5º dia do ciclo). Mulheres com oligo/amenorréia poderão ser submetidas à US ao acaso ou do 3-5º do fluxo menstrual após sangramento induzido por progestagênios15.
Exames complementares para diagnóstico diferencial
Alguns exames laboratoriais são importantes para excluir outras causas de hiperandrogenismo e anovulação, que podem simular SOP14:
- Testosterona total (se > 200 ng/dL suspeitar de tumor de ovário produtor de androgênio);
- Sulfato de deidroepiandrosterona (S-DHEA) (se > 700 ng/dL, suspeitar de tumor de supra-renal produtor de androgênio);
- B-hCG (afastar gravidez);
- Hormônio folículo-estimulante (FSH) (para diagnóstico diferencial com FOP em casos de alterações menstruais);
- 17-hidroxiprogesterona, que é o principal marcador da hiperplasia adrenal congênita (deficiência da 21-hidroxilase), sendo principal diagnóstico diferencial da SOP;
- Hormônio tireo-estimulante (TSH) (suspeita de distúrbio tireóideo);
- Teste ACTH na suspeita de síndrome de Cushing (estrias violáceas, face de lua cheia, etc.);
- Prolactina, para exclusão de hiperprolactinemia (embora possa estar elevada em casos de SOP)
Avaliação da Síndrome Metabólica
No exame clínico recomenda-se avaliação da pressão arterial (PA), considerando-se normal < 130×85 mmHg, circunferência da cintura (CC) , cujo valor anormal é maior que 88 cm, índice de massa corporal (IMC), considerando pré-obesas de 25 a 29,9 Kg/m² e obesas ≥ 30 Kg/m²18,21. Esses parâmetros poderão levar a uma suspeita de síndrome metabólica (Quadro 2), que é um importante preditor de risco futuro para doença cardiovascular22,23.
Em mulheres com sobrepeso ou obesas (IMC ≥ 25 Kg/m²)14,21, com acanthosis nigricans21,22 ou com obesidade central (CC > 88 cm)21:
- Teste de tolerância oral a glicose (TTOG 75g) para rastreamento de intolerância à glicose ou DM tipo 2;
- Perfil lipídico para rastreamento de síndrome metabólica;
- Glicemia (G) e insulina (I) de jejum para rastreamento de resistência insulínica, podendo-se utilizar os seguintes índices:
o HOMA (Homeostasis Model Assesment for Insulin Resistance):
HOMA-IR = G (mg/dL) x I (UI/mL) (Normal < 2,71)24 405
(5) Tratamento
Com os novos conhecimentos sobre a fisiopatologia da SOP, a filosofia de tratamento da SOP é direcionada à sua natureza plurimetabólica e consequências em longo prazo. Como se trata de uma doença de etiologia ainda desconhecida, a abordagem é restrita à redução de sintomas e sinais indesejáveis, e à diminuição dos riscos associados às alterações metabólicas; devem ser abordados itens como modificações do estilo de vida, tratamento do fenótipo (irregularidade menstrual e hiperandrogenismo), correção dos distúrbios metabólicos e desejo de concepção.
Estilo de Vida
Há evidências crescentes de que mulheres com SOP podem ter benefício pela adoção de dietas com restrição glicêmica, com alívio da hiperinsulinemia e suas conseqüências metabólicas. Aceita-se que também a perda ponderal de 5% a 7%, associada a exercícios físicos, amenize as manifestações de hiperandrogenismo, reduza a hiperinsulinemia e favoreça o retorno de ciclos ovulatórios em 75% dos casos, com ocorrência de gravidez espontânea em algumas pacientes18,25. Por isso, modificações dos hábitos alimentares e redução do peso corporal são consideradas medidas de primeira linha para tratamento de pacientes com SOP, principalmente as obesas18,23,25.
Tratamento dos Distúrbios Metabólicos
Em pacientes com SOP com alterações metabólicas, como resistência insulínica e dislipidemia, pode-se iniciar terapêutica específica para correção dos distúrbios e esperada melhora do hirsutismo, retorno dos ciclos dos ovulatórios, e perda ponderal18,25,26.
A resistência à insulina é considerada o principal ou um dos principais mecanismos envolvidos na etiopatogenia da SOP e, assim, sua correção assume grande importância na abordagem terapêutica do problema.
A metformina é um hipoglicemiante da classe das biguanidas de segunda geração, que atua primariamente na supressão da gliconeogênese hepática20 e na recaptação periférica da glicose7. Pode ser usada em mulheres com RI, obesas ou com intolerância a glicose, associada às mudanças de estilo de vida18,20,25,27. A metformina leva a melhores resultados nas taxas de ovulação quando comparados ao placebo em mulheres com SOP e sua manutenção na gravidez parece ser benéfica na prevenção de aborto no primeiro trimestre18,25. É uma droga da categoria B do FDA, o que significa que não existem estudos suficientes em humanos; todavia, não foram de¬monstrados efeitos teratogênicos em animais18. A dose recomendada é de 850 mg a 2.500mg/dia (dividida em duas a três vezes), sendo habitualmente iniciada em doses menores, que podem ser aumentadas de acordo com acompanhamento clínico7,18,23. Apresenta efeitos colaterais indesejados, como náuseas, dor abdominal, diarréia e anorexia, que são sensivelmente reduzidos nas formulações de liberação lenta e podem ser usadas em dose única18,23.
As estatinas têm recebido apoio emergente na literatura para um benefício cardiovascular e endócrino em mulheres com SOP, mas seus efeitos em longo prazo na prevenção de doenças cardiovasculares em mulheres jovens ainda são incertos18, assim como o são as consequências do uso durante a gestação.
Recentemente, tem estudos mostrando que a suplementação com inositol oral, melhora a resistência à insulina, hiperandrogenismo, regularidade dos ciclos menstruais e qualidade do oócito em pacientes com SOP. No entanto, estudos prospectivos com base em grandes coortes, devem ser feitos a fim de esclarecer o papel central das isoformas de inositol no tratamento. (*2)
Existem publicações mostrando beneficios da cirurgia bariatrica, em pacientes com IMC acima de 35 Kg/m². Melhorando irregularidade menstrual, hirsutismo entre outras manifestações da SOP. (*3)
Tratamento Antiandrogênico
O tratamento clínico objetiva a supressão da produção ovariana ou adrenal de androgênios, ou o bloqueio de sua ação na pele28. A resposta terapêutica costuma ser lenta, devendo o tratamento ser feito por um período mínimo de seis a nove meses no caso do hirsutismo, e cerca de três meses nos de acne, observando-se recorrência caso o tratamento seja interrompido18. Somente tratamentos de remoção de pêlo de longa duração, como eletrólise e remoção a laser podem ser recomendadas para um melhor resultado estético28.
- Anticoncepcionais combinados (ACO): Promovem a supressão do hormônio luteinizante (LH), resultando em inibição da biossíntese de androgênios, estimulação da SHBG (que leva à diminuição dos androgênios livres, que são biologicamente ativos) e moderada redução na síntese androgênios adrenais. Os anticoncepcionais combinados de estrogênio e progestágeno são a primeira linha de tratamento de hirsutismo moderado e acne18,28. Os derivados progestínicos com menor atividade androgênica (gestodeno, desogestrel) ou maior atividade anti-androgênica (ciproterona, drospirenona) têm um perfil metabólico e biológico mais favorável28, dando-se preferência às combinações que contenham ciproterona e drospirenona7, embora por embasamento apenas teórico, visto que ainda não há dados que sustentem essa hipótese28. (*5)
- Espironolactona: Tem ação antiandrogênica causada pelo aumento do clearance dos androgênios (inibição da síntese de aldosterona), inibição da atividade da 5-redutase e da síntese de androgênios ovarianos e adrenais, elevação da SHBG e pelo bloqueio receptores androgênicos específicos da pele18,28. É considerado como primeira linha para pacientes obesas18 e segunda linha para aquelas com hirsutismo moderado a severo28. A dose inicial é 100mg/dia, mas pacientes obesas usualmente requerem 200-300/dia18,28. Geralmente, há necessidade de associá-la aos ACO na presença de irregularidade menstrual e não costuma melhorar a acne isoladamente28,29; a gestação não deve ocorrer durante o uso da espironolactona7.
- Acetato de Ciproterona: É um antiandrogênico potente, que também age sobre a 5-redutase, evitando a conversão de testosterona em diidrotestosterona28. É considerado como primeira linha para tratamento de hirsutismo moderado a severo. A dose padrão 50mg/dia – começando com 12,5mg/dia e aumentada progressivamente – durante 20 dias por mês, associado com estrogênio em baixas doses, que nestes casos melhora sensivelmente a acne28,30. Pode ser utilizado com ACO, mesmo que este já contenha ciproterona. A gestação não deve ocorrer durante o uso da ciproterona7. (*5)
- Finasterida: é um potente inibidor da isoenzima tipo 2 da 5-redutase; a dose recomendada é de 2,5 a 7,5 mg/dia, mas seu uso deve ser restrito a casos selecionados, pelo risco de teratogenicidade, hepatotoxidade e pelo efeitos colaterais18,28. A gestação não deve ocorrer durante o uso da finasterida.
- Flutamida: é um antiandrogênio puro não-esteróide que age bloqueando o receptor de androgênio; a dose preconizada é de 250 a 500 mg/dia, mas seu uso deve ser restrito a casos selecionados, pelo risco de teratogenicidade, hepatotoxidade e pelo efeitos colaterais18,28. A gestação não deve ocorrer durante o uso da flutamida.
Tratamento dos Distúrbios Menstruais
A correção do distúrbio menstrual primário pode ser feita com uso de ACO, recomenda-se ACO com baixa dosagem de etinilestradiol (20 ou 30 g)18. Não há evidências suficientes para determinar a combinação de ACO mais eficaz no controle de distúrbios menstruais em mulheres com SOP18.
O progestagênio oral isolado ou o sistema intrauterino contendo levonogestrel (SIU-LNG) também podem ser utilizados, porém estão associados com sangramento uterino anormal em 50 a 89% das usuárias18. A prevenção de câncer endometrial em mulheres com SOP através do uso em regime cíclico de progestágenos orais ou de SIU-LNG ainda é desconhecida18.
Tratamento da Infertilidade
Caso as medidas para perda ponderal, a terapêutica para correção dos distúrbios metabólicos não tenham sucesso na correção do distúrbio ovulatório, ou a mulher com SOP não tenha aderido ao tratamento e esteja com IMC abaixo de 30 Kg/m², recomenda-se terapêutica farmacológica25.
- Citrato de Clomifeno (CC). O CC é um modulador seletivo de receptor de estrogênio (SERM) e exibe atividade estrogênica (agonista) e antiestrogênica (antagonista)25. É a primeira opção tera¬pêutica para mulheres com infertilidade por SOP 18,25. Procura-se utilizar a menor dose possível a fim de evitar o efeito antiestrogênico sobre o endométrio, administrando-se de 50-150mg/dia durante cinco dias, iniciando-se do 3º-5º dia de fluxo menstrual18,25. Aproximadamente 80% das pacientes ovulam após uso do CC, mas a gravidez acontece apenas 20-40% dos casos e a gravidez múltipla menor que 10%18,25. De maneira geral o tratamento é limitado a seis ciclos, com taxa cumulativa de nascido vivo de 50-60%25.
O acompanhamento ultrassonográfico não é mandatório para o sucesso do tratamento, mas considera-se adequada a prática de monitorizar os ciclos estimulados, para ajuste da dose e prevenção de hiperestímulo ovariano25 e confirmação da resposta ovariana a cada evento.
A adição de metformina em pacientes com SOP melhora as taxas de gravidez e nascidos vivos31. Observaram-se também resultados superiores naquelas clomifeno-resistentes, mas não foi possível identificar quanto tempo de uso de metformina antes do uso do CC seria necessário para melhorar essa resposta31.
A adição de dexametasona ao CC parece promissora, mas ainda necessita de estudos controlados32. Trata-se de uma medicação efetiva e caracterizada por baixo custo, poucos efeitos colaterais e simplicidade de administração.
Inibidores da aromatase (letrozole) podem ser usados, como alternativa na indução da ovulação em pacientes que tem o endométrio comprometido quando usado o CC.(*4). Dose inicial de 2,5 mg/dia por 5 dias, podendo aumentar até 7,5 mg dia, se não houver ovulação, iniciando do terceiro ao quinto dia do ciclo ou após sangramento provocado com progesterona. (*6)
- Gonadotrofinas. Nos casos em que não se consegue resposta terapêutica com o uso do CC, no intuito de promover a indução da ovulação para as mulheres com SOP, torna-se imperioso o uso de gonadotrofinas para essas mulheres – segunda linha18,25. A dose inicial recomendada de gonadotrofinas é de 37,5 a 50,0 UI/dia25. É necessária a monitorização ovariana para reduzir as complicações, como a síndrome de hiperestímulo ovariano ou gestação múltipla25. Recomenda-se que o tratamento não exceda a seis ciclos ovulatórios25.
- Técnica de Reprodução Assistida (TRA). Mulheres com SOP podem ser tratadas com técnicas de reprodução assistida – fertilização in vitro (FIV) ou injeção intracitoplasmática de espermatozóides (ICSI) – quando ocorre falha na tentativa de gravidez com a indução da ovulação para coito programado ou inseminação intra-uterina, ou quando o casal tem outra causa de infertilidade associada, como fator tubo peritoneal (obstrução tubária, endometriose moderada e grave) e/ou fator masculino18,25. Atualmente, se prefere utilizar protocolo antagonista, fazer a maturação oocitária com agonista do GnRH e vitrificar óvulos ou embriões, para programar transferência em outro momento, diminuindo assim o risco de SHO, alguns autores recomendam o uso de metformina concomitante.(*4). A transferência de um menor número de embriões também está associada a menores riscos de gestação múltipla25.
- Coagulação Laparoscópica Ovariana (CLO). A CLO ou drilling ovariano, que consiste em realizar pequenas perfurações nos ovários através de eletrodo pontiagudo monopolar, bipolar ou laser, é uma alternativa terapêutica à indução com gonadotrofinas para mulheres com SOP, resistente ao citrato de clomifeno18,25. É considerada terapia de segunda linha para anovuladoras com SOP18,25. Este tipo de procedimento é efetivo em menos de metade das mulheres e a indução com gonadotrofinas pode ser requerida. A indução da ovulação pós-cirurgia ovariana, em geral, está associada a altas taxas de ovulação e o baixo risco de gravidez múltipla são seus pontos positivos18,25. Devemos ter cautela na indicação deste tipo de cirurgia, principalmente no que diz respeito aos riscos de destruição de tecido ovariano e formação de aderências, com possíveis seqüelas sobre a reserva ovariana e fertilidade destas mulheres, embora não haja número de estudos suficientes para uma conclusão definitiva25. (*4)
(6) Conclusão
Os fenótipos heterogêneos e a complexa rede de mecanismos propostos para a etiopatogenia da SOP geram controvérsias que repercutem, principalmente, no estabelecimento consensual de critérios diagnósticos. Embora dúvidas existam, recomenda-se o uso dos critérios de Rotterdam na prática clínica.
Como perspectiva futura, a pesquisa molecular caminha para correlação dos fenótipos da SOP ao genótipo através da identificação de polimorfismos funcionais nos genes que regulam o eixo hipotálamo-hipófise-ovariano, responsáveis pela função ovulatória, que podem corresponder a fenótipos mais graves da SOP, como hiperandrogenismo intenso ou amenorréia33.
Mesmo diante de tantas incertezas o tratamento da SOP apresenta-se de alguma forma eficaz que em quase todas as suas manifestações, com destaque para cuidados com o controle do peso corporal, avaliação clínica cuidadosa dos fatores de risco para síndrome metabólica e adoção de medidas específicas para correção das alterações identificadas, tendo a paciente como co-responsável e procurando acompanhamento multidisciplinar18.
(7) Referências
- March WA, Moore VM, Willson KJ, Phillips DI, Norman RJ; Davies MJ. The prevalence of polycystic ovary syndrome in a community sample assessed under contrasting diagnostic criteria. Hum Reprod. 2010;25(3):544-51.
- Stein IF, Leventhal ML. Amenorrhea associated with bilateral polycystic ovaries. Am J Obstet Gynecol. 1935;29:181-91.
- Goodarzi MO, Korenman SG. The importance of insulin resistance in polycystic ovary syndrome. Fertil Steril. 2003;80:255-8.
- Norman RJ, Dewailly D, Legro RS, Hickey TE. Polycystic ovary syndrome. Lancet. 2007;370(9588):685-97.
- Soares EMM, Azevedo GD, Gadelha RGN, Lemos TMAM, Maranhão TMO. Prevalence of the metabolic syndrome and its components in Brazilian women with polycystic ovary syndrome. Fertil Steril. 2008;89(3):649-55.
- Soares GM, Vieira CS, Martins WP, Franceschini SA, dos Reis RM, de Sá MFS, et al. Increased arterial stiffness in nonobese women with polycystic ovary syndrome (PCOS) without comorbidities: one more characteristic inherent to the syndrome? Clin Endocrinol. 2009;71(3):406-11.
- Reis RM; Rosa e Silva ACJS; Navarro PAAS; Silva de Sá MF. Doenças relacionadas à infertilidade. In: Ferriani RA, Navarro PAAS (Eds). Protocolos de condutas em infertilidade conjugal. Setor de Reprodução Humana, Departamento de Ginecologia e Obstetrícia, Faculdade de Medicina de Ribeirão Preto – USP. São Paulo: Conexão Brasil (2004).
- Escobar-Morreale HF, Luque-Ramirez M, San Millan JL. The molecular-genetic basis of funcional hyperandrogenism and the polycystic ovary síndrome. Endocr Rev. 2005;26:251-82.
- Dunaif A. Insulin resistance and the polycystic ovary syndrome: mechanisms and implications for pathogenesis. Endocr Rev. 1997;18:774-800.
- Gilling-Smith C, Wiliis DS, Beard RW, Franks S. Hypersecretion of androstenedione by isolated thecal cells from polycystic ovaries. J Clin Endocrinol Metab. 1994;79:1158-65.
- Homburg R. Involviment of growth factors in the pathophysiology of polycystic ovary syndrome. Gynecol Endocrinol. 1998;12:391-7.
- Baillargeon JP, Nestler JE. Polycystic ovary syndrome: a syndrome of ovarian hypersensivity of insulin? J Clin Endocrinol Metab. 2006;91:22-4.
- Zawadzki JK, Dunaif A. Diagnostic criteria for polycystic ovary syndrome: a rational approach. In: Dunaif A, Gives JR, Haseltine F, Merriam GR, editors. Polycystic ovary syndrome. Cambridge: Blackwell Scientific; 1992.p.377-84.
- Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome. Rotterdam ESHRE/ASRM-Sponsored PCOS consensus Workshop Group. Fertil Steril. 2004;81:19-25.
- Balen AH, Laven JSE, Tan SL, Dewailly. Ultrasound assessment of the polycystic ovary: international consensus definitions. Hum Reprod Update. 2003;9(6):505-14.
- Azziz R, Carmina E, Dewaily D, Diamanti-Kandarakis E, Escobar-Morreale HF, futterweit W et al. Positions statement: criteria for defining polycystic ovary syndrome as a predominantly hyperandrogenic syndrome: an androgen excess society guideline. Androgen Excess Society. J Clin Endocrinol Metab 2006;91:4237-45.
- Azziz, R. Diagnosis of polycystic ovarian syndrome: the Rotterdam Criteria are premature. J Clin Endocrinol Metab 2006;91:781-5.
- ACOG Practice Bulletin. Polycystic Ovary Syndrome. Obstet Gynecol. 2009;114(4):936-49.
- Hatch R. Hirsutism implications etiology and management. Am J Obstet Gynecol. 1981;140:815-30.
- Pugeat M, Déchaud H, Raverot V, Denuzière A, Cohen R, Boudou P. Recommendations for investigation of hyperandrogenism. Consensus of French Endocrine Society on female hyperandrogenism. Annals of Endocrinology 71. 2010;2-7.
- Dewailly D, Hieronimus S, Mirakian P, Hugues J-N. Polycystic ovary syndrome (PCOS). Consensus of French Endocrine Society on female hyperandrogenism. Annals of Endocrinology 71. 2010;9-13.
- Grundy SM, Cleeman JI, Daniels SR, Donato KA, Eckel RH, Franklin BA, Gordon DJ, Krauss RM, Savage PJ, Smith SC, Spertus-Jr JA, Costa F. Diagnosis and management of the metabolic syndrome: an American Heart Association/National Heart, Lung, and Blood Institute Scientific Statement: Executive Summary. Circulation. 2005;112:285-90.
- Practice Committee of the American Society for Reproductive Medicine. Use of insulin-sensitizing agents in the treatment of polycystic ovary syndrome. Fertil Steril. 2008;90(Suppl3):S69-72.
- Geloneze B, Repetto EM, Geloneze SR, Tambascia MA, Ermetice MN. The threshold value for insulin resistance (HOMA-IR) in an admixture population in the Brazilian Metabolic Syndrome Study. Diabetes Res Clin Pract. 2006;72:219-20.
- Consensus on infertility treatment related to polycystic ovary syndrome. The Tessaloniki ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group. Fertil Steril. 89(3):505-22.
- Tang T, Lord JM, Norman RJ, Yasmin E, Balen AH. Insulin-sensitising drugs (metformin, rosiglitazone, pioglitazone, Dchiro-inositol) for women with polycystic ovary syndrome, oligo amenorrhoea and subfertility. Cochrane Database of Systematic Reviews. 2010, Issue 1.
- Duranteau L, Lefevre P, Jeandidier N, Simon T, Christin-Maitre S. Should physicians prescribe metformina to women with polycystic ovary syndrome PCOS? Consensus of the French Endocrine Society on female hyperandrogenism. Annals of Endocrinology 71. 2010:25-27.
- Bachelot A, Chabbert-Buffet N, Salenave S, Kerlan V, Galand-Portier MB. Anti-androgen Treatments. Consensus of the French Endocrine Society on female hyperandrogenism. Annals of Endocrinology 71. 2010:19-24.
- Brown J, Farquhar C, Lee O, Toomath R, Jepson RG. Spironolactone versus placebo or in combination steroids for hirsutism and/or acne (Review). The Cochrane Database of Systematic Review. 2009, Issue 2.
- van der Spuy ZM, Le Roux PA, Matjila MJ. Cyproterone acetate for hirsutism. Cochrane Database of Systematic Reviews. 2003, Issue 4.
- Sinawat S, Buppasiri P, Lumbiganon P, Pattanittum P. Long versus short course treatment with Metformin and Clomiphene Citrate for ovulation induction in women with PCOS. Cochrane Database of Systematic Reviews. 2008, Issue 1.
- Brown J, Farquhar C, Beck J, Boothroyd C, Hughes E. Clomiphene and anti-oestrogens for ovulation induction in PCOS. Cochrane Database of Systematic Reviews. 2009, Issue 4.
- Valkenburg O, Uitterlinden AG, Piersma D, Hofman A, Themmen APN, de Jong FH, Fauser BCJW, Laven JSE. Genetic polymorphisms of GnRH and gonadotrophic receptors affect the phenotype of polycystic ovary syndrome. Hum Reprod. 2009;1(1):1-9.
(*1) The AmsterdamESHRE/ASRM-Sponsored 3rd PCOS ConsensusWorkshop
Group, “Consensus on women’s health aspects of polycystic ovary syndrome (PCOS),” Human Reproduction, vol.
27, no. 1 14–24, 2012.
(*2)Review Article
Metabolism and Ovarian Function in PCOS Women:
A Therapeutic Approach with Inositols
Antonio Simone Laganà,1 Paola Rossetti,2 Massimo Buscema,2 Sandro La Vignera,3
Rosita Angela Condorelli,3 Giuseppe Gullo,1 Roberta Granese,1 and Onofrio Triolo1, pp.
International Journal of Endocrinology
Volume 2016, Article ID 6306410, 9 pages
http://dx.doi.org/10.1155/2016/6306410
(*3) Review Article
Bariatric Surgery, Polycystic Ovary Syndrome, and Infertility
James Butterworth,1 Jean Deguara,2 and Cynthia-Michelle Borg1
1University Hospital Lewisham, Lewisham and Greenwich NHS Trust, London, UK
2Kingston Hospital NHS Foundation Trust, Kingston uponThames, UK
Correspondence should be addressed to Cynthia-Michelle Borg; cynthia.borg@gmail.com
Received 28 August 2016; Revised 16 October 2016; Accepted 18 October 2016
(*4) Hum Reprod Update. 2016 Aug 10. [Epub ahead of print]
The management of anovulatory infertility in women with polycystic ovary syndrome: an analysis of the evidence to support the development of global WHO guidance.
Balen AH1, Morley LC2, Misso M3, Franks S4, Legro RS5, Wijeyaratne CN6, Stener-Victorin E7, Fauser BC8, Norman RJ9, Teede H3.
(*5) Best Pract Res Clin Obstet Gynaecol. 2016 May 19. pii: S1521-6934(16)30022-0. doi: 10.1016/j.bpobgyn.2016.05.003. [Epub ahead of print]
Androgen excess: Investigations and management.
Lizneva D1, Gavrilova-Jordan L2, Walker W2, Azziz R3.
Este artigo faz parte da Dissertação de Mestrado intitulada “nome do artigo da dissertação” para obtenção do título de Mestre em Ginecologia, Obstetrícia e Mastologia pela Faculdade de Medicina da UNESP/Botucatu, apresentada em mês de 2011. A pesquisa obteve financiamento da FEPECS.